Autophagie ist das wichtigste intrazelluläre Abbausystem, durch das zytoplasmatische Materialien an das Lysosom abgegeben und dort abgebaut werden.
Der Zweck der Autophagie ist jedoch nicht die einfache Beseitigung von Materialien, sondern die Autophagie dient als dynamisches Recyclingsystem, das neue Bausteine und Energie für die Zellerneuerung und Homöostase erzeugt.
Hier geben wir einen multidisziplinären Überblick über unser derzeitiges Verständnis der Rolle der Autophagie bei der metabolischen Anpassung, der intrazellulären Qualitätskontrolle und der Erneuerung während der Entwicklung und Differenzierung.
Wir untersuchen auch, wie neuere Mausmodelle in Kombination mit Fortschritten in der Humangenetik wichtige Erkenntnisse darüber liefern, wie die Beeinträchtigung oder Aktivierung der Autophagie zur Pathogenese verschiedener Krankheiten beiträgt.
Warum ist eine Autophagie nötig?
Alle lebenden Organismen werden ständig erneuert. Beim Menschen werden Zellen und intrazelluläre Komponenten ständig umgebaut und recycelt. Dies dient zum Teil dazu, alte Komponenten durch frische, qualitativ bessere zu ersetzen. Wenn jedoch Komponenten durch andere Typen ersetzt werden, ergibt sich eine Nettoveränderung des Charakters.
Eine solche „zelluläre Erneuerung“ erfordert die Synthese neuer Komponenten, aber auch den Abbau bereits vorhandener Materialien, die als Bausteine dienen können.Eukaryontische Zellen haben zwei Hauptabbausysteme, das Lysosom und das Proteasom. Der proteasomale Abbau weist eine hohe Selektivität auf; Das Proteasom erkennt im Allgemeinen nur ubiquitinierte Substrate, bei denen es sich hauptsächlich um kurzlebige Proteine handelt. Im Gegensatz dazu folgt der Abbau im Lysosom nicht einem so einfachen Muster.
Extrazelluläres Material und Plasmamembranproteine können zum Abbau über den endozytischen Weg an Lysosomen abgegeben werden. Darüber hinaus können zytosolische Komponenten und Organellen auch durch Autophagie an das Lysosom abgegeben werden.
Das Lysosom wird oft als „zelluläre Mülltonne“ beschrieben, und seine positiveren Rollen bei der Zellerneuerung, insbesondere bei der Autophagie, wurden nicht gut gewürdigt. In den 1990er Jahren identifizierten genetische Studien an Hefen eine Reihe von autophagiebezogenen ( ATG ) Genen (Klionsky et al., 2003, Nakatogawa et al., 2009). Die Ergebnisse dieser Studien haben unser Verständnis des Mechanismus und der Funktion der Autophagie erheblich verbessert.
Insbesondere Analysen von Organismen mit Autophagiedefekt haben zahlreiche physiologische und pathologische Rollen der Autophagie sowohl auf zellulärer als auch auf Ebene des gesamten Organismus gezeigt. In diesem Aufsatz fassen wir das aktuelle Wissen über Autophagie zusammen und diskutieren die multidisziplinäre Funktion der Autophagie bei der Renovierung der Zelle und des Organismus.
Mechanismen der Autophagie
Autophagie ist ein Oberbegriff für alle Wege, über die zytoplasmatische Materialien in tierischen Zellen an das Lysosom oder in Pflanzen- und Hefezellen an die Vakuole abgegeben werden.
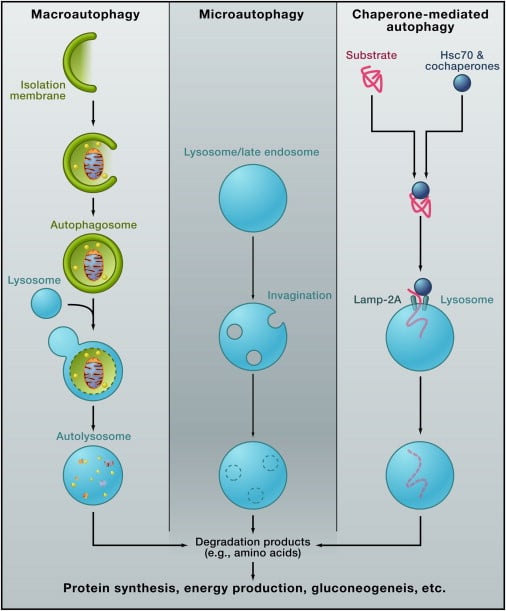
Es gibt ungefähr drei Klassen von Autophagie (Abbildung 1): Makroautophagie, Mikroautophagie und Chaperon-vermittelte Autophagie. Bei der Makroautophagie wird das intermediäre Organellen-Autophagosom verwendet.
Eine Isolationsmembran (auch Phagophor genannt) bindet einen kleinen Teil des Zytoplasmas, einschließlich löslicher Materialien und Organellen, um das Autophagosom zu bilden. Das Autophagosom verschmilzt mit dem Lysosom, um ein Autolysosom zu werden und die darin enthaltenen Materialien abzubauen. Autophagosomen können vor der Fusion mit Lysosomen mit Endosomen fusionieren.
Bei der Mikroautophagie verschlingt das Lysosom selbst kleine Bestandteile des Zytoplasmas durch innere Invagination der Lysosomenmembran ( Abbildung 1 ).
Die Membrandynamik während der Mikroautophagie kann der des endosomalen Sortierkomplexes, der für die Transport (ESCRT) -abhängige Bildung des multivesikulären Körpers (MVB) im späten Endosom erforderlich ist, sehr ähnlich oder identisch sein.
Tatsächlich werden während der MVB-Bildung sowohl in großen Mengen als auch selektiv signifikante Mengen an cytosolischen Proteinen in das endosomale Lumen eingebaut (Sahu et al., 2011).Die dritte Art der Autophagie ist die Chaperon-vermittelte Autophagie.
Diese Klasse beinhaltet keine Membranreorganisation; Stattdessen translozieren Substratproteine während der Chaperon-vermittelten Autophagie direkt über die Lysosomenmembran (Abbildung 1).
Das Chaperonprotein Hsc70 (Hitzeschock cognate 70) und Cochaperone erkennen spezifisch cytosolische Proteine, die ein KFERQ-ähnliches Pentapeptid enthalten (Orenstein und Cuervo, 2010).
Das Transmembranprotein Lamp-2A, eine Isoform von Lamp-2, wirkt als Rezeptor auf dem Lysosom, und ungefaltete Proteine werden über einen multimeren Translokationskomplex in das lysosomale Lumen abgegeben.
Es wird angenommen, dass die Makroautophagie die Hauptart der Autophagie ist, und sie wurde im Vergleich zur Mikroautophagie und der Chaperon-vermittelten Autophagie am ausführlichsten untersucht. Daher bezeichnen wir hier die Makroautophagie einfach als „Autophagie“.
Häufige Fragen – FAQ
Autophagie ist ein zellulärer Selbstreinigungsprozess, bei dem Zellen beschädigte Proteine und Organellen abbauen und recyceln. Es wird angenommen, dass dieser Prozess eine wichtige Rolle für die Zellgesundheit spielt und vor verschiedenen Krankheiten schützen kann.
Hier sind Antworten auf Ihre Fragen:
Wie lange sollte man in der Autophagie sein?
Es gibt keine festgelegte Zeitdauer, für die man in der Autophagie sein sollte. Die Dauer, in der Autophagie auftritt, kann je nach den Umständen variieren. Viele Menschen praktizieren intermittierendes Fasten (z.B. 16 Stunden Fasten, 8 Stunden Essen), um die Autophagie zu fördern. Längere Fastenzeiten können zu einer stärkeren Aktivierung der Autophagie führen, aber es gibt auch Risiken bei zu langem Fasten.
Was darf man bei Autophagie essen?
In der strengsten Form des Fastens, das die Autophagie fördert, sollte man gar nichts essen. Man kann jedoch Wasser, ungesüßten Tee oder schwarzen Kaffee trinken.
Hat die Autophagie auch Nachteile?
Zu viel Autophagie kann schädlich für den Körper sein, da es zu einem übermäßigen Abbau von nützlichen zellulären Komponenten führen kann. Ein Ungleichgewicht in der Autophagie kann auch mit verschiedenen Krankheiten in Verbindung gebracht werden.
Was beschleunigt die Autophagie?
Fasten oder Kalorienrestriktion kann die Autophagie fördern. Auch bestimmte Verbindungen wie Rapamycin oder Resveratrol können den Prozess beschleunigen. Körperliche Betätigung kann ebenfalls die Autophagie anregen.
Welche Lebensmittel unterbrechen die Autophagie nicht?
Wasser, schwarzer Kaffee und ungesüßter Tee werden im Allgemeinen als sicher angesehen und sollten die Autophagie nicht unterbrechen. Es gibt jedoch keine vollständige Liste von Lebensmitteln, die garantiert die Autophagie nicht beeinflussen.
Welche Lebensmittel unterbrechen die Autophagie?
Jedes Lebensmittel, das Kalorien oder Makronährstoffe (Proteine, Kohlenhydrate, Fette) enthält, kann potenziell die Autophagie unterbrechen. Insbesondere wird angenommen, dass Aminosäuren (die in Proteinen enthalten sind) den Autophagie-Prozess unterbrechen können.
Es ist wichtig zu betonen, dass das Verständnis der Autophagie und ihrer Rolle im menschlichen Körper noch in der Erforschung ist. Wenn Sie daran denken, Fasten oder andere Strategien zur Förderung der Autophagie auszuprobieren, sollten Sie dies mit einem Arzt oder Ernährungsberater besprechen.